第22回 冷却水などの水質分析項目にある塩化物イオンと残留塩素の違いとそれぞれの腐食に対する作用の違いについて教えてください。
冷却水の水質分析項目中には、塩素に関連する項目として、「塩化物イオン」と「残留塩素」があります。両方とも腐食を加速する作用がありますが、腐食加速のメカニズムと腐食が問題になる濃度が大きく異なります。
塩素に関連する項目を「塩素」などと一括りにし、両者が混同されている場合がありますが、「塩化物イオン」と「残留塩素」の違いを理解し、区別して管理することが重要です。
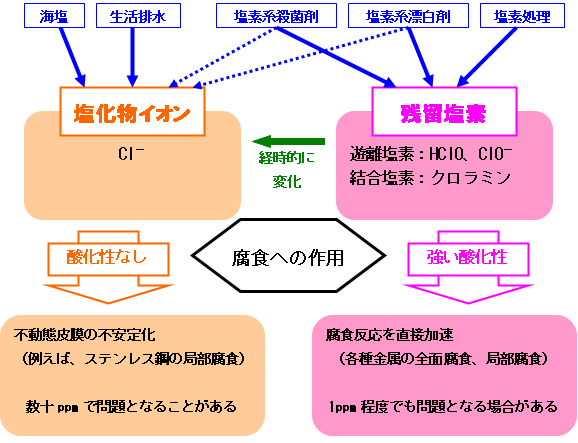
塩化物イオンとは、Cl-を指します。塩化物イオンは、海塩や生活排水、塩素系殺菌剤等から水中に混入します。
残留塩素は、遊離塩素と結合塩素をあわせたものです。遊離塩素は、HClO(次亜塩素酸)およびClO-(次亜塩素酸イオン)です。遊離塩素は有効塩素とも呼ばれます。結合塩素は、遊離塩素がアンモニアと反応したクロラミン(例えば、NH2Cl)です。アンモニアが少ない水の場合は、残留塩素は遊離塩素にほぼ等しくなります。残留塩素は、アンモニアの分解や殺菌処理、漂白処理のための塩素処理や次亜塩素酸ナトリウム添加により水中に存在します。
なお、残留塩素は、自然環境で安定性が小さく、経時的に塩化物イオンに変化します。また、殺菌剤として添加される塩素系薬剤中には、残留塩素と塩化物イオンの両者が含まれますので、殺菌剤を添加することで残留塩素濃度とともに塩化物イオン濃度も増加します。
腐食は酸化反応ですので、環境の酸化性が腐食進行に大きく影響します。塩化物イオンと残留塩素の腐食に対する作用の違いは、主に酸化性の有無に起因します。
塩化物イオンの塩素は-1価で酸化性を持ちません。遊離塩素である次亜塩素酸および次亜塩素酸イオンの塩素は+1価で強力な酸化性を有しています。酸化性が殺菌作用を発揮するため、遊離塩素は殺菌剤として利用されています。水道水では、衛生上0.1ppm以上存在することが規定されています。
金属の腐食に対し、塩化物イオンは、金属の不動態皮膜を不安定にする作用があります。特に、ステンレス鋼の局部腐食(すき間腐食や応力腐食割れ)の発生原因となります。材料の種類や塩化物イオン以外の環境要因(酸化性など)にもよりますが、中性水溶液の場合、おおよそ数十ppm以上で腐食が問題になる場合があります。
一方、残留塩素は、強い酸化性により金属の腐食を加速する作用があります。例えば、炭素鋼の全面腐食を加速したり、ステンレス鋼の局部腐食を促進したりします。材料の種類や残留塩素以外の環境要因にもよりますが、1ppm程度の濃度で問題となる場合もあります。
付図 塩化物イオンと残留塩素の主な違い