GLUTAMINE SYNTHETASE [GSⅡ]
from Bacillus sp.
(L-Glutamate: ammonia Ligase (ADP-forming) , EC 6.3.1.2)
ATP + L–glutamate + NH3 → ADP + Orthophosphate + L–glutamine
Preparation and Specification
- Appearance
- : White to pale brownish lyophilized powder
- Specific activity
- : More than 15U/mg
- Contaminants
- : NADH oxidase Less than 0.05% (U/U)
Properties
- Michaelis constant
- : NH4C1 0.05 mM
Glutamic acid 10.9 mM
- Isoelectric point
- : pH 4.85
- Molecular weight
- : 500KDa (TSK G3000SWXL)
53KDa (SDS–PAGE)
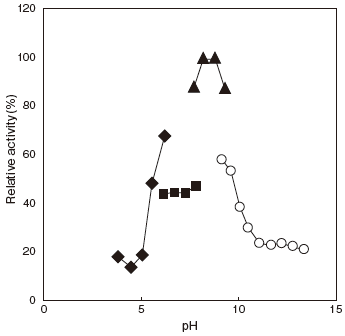
- Optimum pH
- : 8–9Figure 1
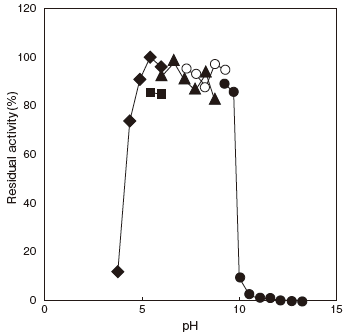
- pH stability
- : 5.0–9.5 (37℃, 60min) Figure 2
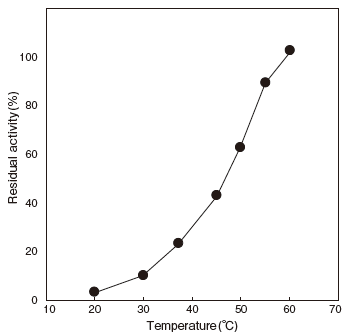
- Optimum temperature
- : 60℃ (pH8.0, 50mM Tris–HCl buffer) Figure3
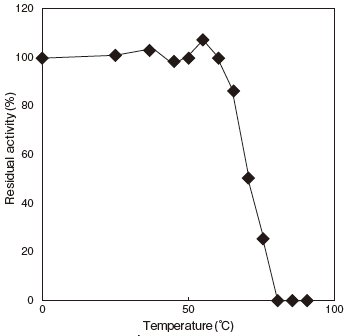
- Thermal stability
- : Stable at 60℃ and below (pH8.0, 10min) Figure4
- Storage stability
- : -20℃
- Effect of metal ions
- : See Table 1
Applications for Diagnostic Test
This enzyme is useful for elimination of ammonia in a diagnostic reagent.
| GS Ⅱ | ||
| ATP + L-glutamate + NH3 | → | ADP + Orthophosphate + L-glutamine |
Table 1. Effect of metal ions GSⅡ activity
| Metal | % | Metal | % |
|---|---|---|---|
| None |
100 |
AgCl |
82 |
| NaCl | 101 | CsCl | 90 |
| KCl | 97 | NH4Cl | 69 |
| EDTA | 0 | ZnSO4 | 0 |
| LiCl | 92 | CuSO4 | 0 |
Assay
Principle
- The assay is based on the decrease in absorbance at 340 nm as the consumption of NADH proceeds in the following reactions:
| GSⅡ | ||
| Glutamate+NH3+ATP | → | Glutamine+ADP+Pi |
| PK | ||
| ADP+PEP | → | ATP+Pyruvic acid |
| LDH | ||
| Pyruvic acid+NADH | → | L-Lactic acid+NAD |
PK :Pyruvate kinase
LDH:Lactate dehydrogenase
PEP:Phosphoenol pyruvate
Unit definition
-
One unit is defined as the amount of enzyme which produces 1 μmole of glutamine per minute at 37 ℃ under the conditions specified in the assay procedure.
Reagents
- Reaction mixture
0.2 M Tris-HCl buffer pH 8.0 0.75 ml 60 mM ATP solution pH 8.0 0.30 ml 1 M NH4Cl solution 0.30 ml 30 mM PEP solution 0.20 ml 7.86 mM NADH solution 0.10 ml 0.6 M MgCl2 solution 0.15 ml 100 U/ml PK1) solution 0.10 ml 340 U/ml LDH2) solution 0.10 ml
-
0.45 M Glutamic acid Na 0.60 ml Distilled water 0.40 ml 1) : 100U/ml PK
Stock solution (2000U/ml) of PK with distilled water to make 20–fold solution.2) : 340U/ml LDH
Stock solution (5500U/ml) of LDH with distilled water to make 16–fold solution. - Enzyme dilution buffer
10mM Tris–HCl buffer pH8.0 - Reagent
Tris (hydroxymethyl) aminomethane:Sigma Chemical Co. #T–1503
ATP (2Na・3H2O・Reduced form) : Kyowa Hakko Co., Ltd
NADH (2Na・3H2O・Reduced form) : Kyowa Hakko Co., Ltd
PEP[Phospho (enol) pyruvic acid
tr (i cyclohexylammonium) salt]:Sigma Chemical Co. #P–7252
NH4Cl:FUJIFILM Wako Pure Chemical CorporationSpecial grade #015–02991MgCl2・6H2O:FUJIFILM Wako Pure Chemical CorporationPK:Roche Diagnostics GmbH #10 128 163 001
Special grade #131–00162
LDH:Roche Diagnostics GmbH #10 127 876 001
Glutamic Acid Monosodium Salt:FUJIFILM Wako Pure Chemical Corporation
Special grade #198–02035
Enzyme solution
Accurately weigh about 10 mg of the sample and add enzyme dilution buffer to make a total of 10 ml. Dilute it with enzyme dilution buffer to adjust the concentration as required.
Procedure
- Pipette accurately 3.0 ml of reaction mixture into a small test tube and Preincubate at 37℃
- After 5min. add accurately 60 μl of enzyme solution and mix to start the reaction at 37℃
※ In the case of a test blank add 60 μl of enzyme dilution buffer in place of enzyme solution. - After starting the reaction, measure the rate of increase per minutes in absorbance at 340 nm. The rate must be measured within the linear portion of the absorbance curve. (Ex. Linear range from 3 min to 6 min)
△A/min = (As/min-Ab/min) ≦ 0.15 Abs/minAbsorbance sample : As/min blank : Ab/min
Calculation
- Activity (U/mg) = {(△A/min)/6.3} × 3.06/0.06 × 1/x
6.3 : millimolar extinction coefficient of NADH at 340nm (cm2/ μmol)3.06 : final volume (ml) 0.06 : volume of emzyme solution (ml) X : concentration of the sample in enzyme solution
GSII 活性測定法 (Japanese)
試薬液
- 0.2M Tris-HCl (pH8.0)
Tris 2.42g を精製水80ml に溶解した後、1N HClでpH8.0 (25℃) に調整し、精製水で全容100mlとする。 - 60mM ATP (pH8.0)
ATP-Na 1.816g を精製水80ml に溶解した後、4NNaOH でpH8.0 (25℃) に調整し、精製水で全容50ml とする。 - 1M NH4Cl
NH4Cl 5.349g を精製水で溶解し、全容100ml とする。 - 30mM PEP
PEP 0.698g を精製水で溶解し、全容50ml とする。 - 7.86mM NADH
NADH31mg を5ml 精製水で溶解する。 - 0.6M MgCl2・6H2O
MgCl2 12.198g を精製水で溶解し、全容100ml とする。 - 100U/ml PK
原液 (2000U/ml) を精製水にて20 倍希釈して使用。 - 340U/ml LDH
原液 (5500U/ml) を精製水にて16 倍希釈して使用。 - 0.45M グルタミン酸Na
グルタミン酸Na 8.421g を精製水で溶解し、全容100ml とする。 - 反応試薬混合液
0.2M トリス-HCl 緩衝液 pH8.0 0.75 ml 60mM ATP pH8.0 0.3 ml 1M NH4Cl 0.3 ml
-
30mM PEP 0.2 ml 7.86mM NADH 0.1 ml 0.6M MgCl2・6H2O 0.15 ml 100U/ml PK 0.1 ml 340U/ml LDH 0.1 mll 0.45M グルタミン酸Na 0.6 ml 精製水 0.4 ml - 酵素溶解希釈用液 (10mM トリス-HCl 緩衝液 pH8.0)
Tris 1.211g を精製水80ml に溶解した後、1N HClでpH8.0 (25℃) に調整し、精製水で全容1L とする。 - 試薬リスト
トリス (ヒドロキシメチル) アミノメタン:シグマ製 #T-1503ATP (アデノシン三リン酸・2Na・3H2O) :協和発酵製
NH4Cl:富士フイルム和光純薬製 特級 #015–02991PEP[ホスホ (エノール) ピルビン酸トリ (シクロヘキシルアンモニウム) 塩]:シグマ製 #P–7252
NADH (2Na・3H2O・還元型) :協和発酵製
MgCl2・6H2O:富士フイルム和光純薬製 特級 #131–00162PK (Pyruvate kinase) :ロシュ製 #10 128 163 001
LDH (Lactate dehydrogenase) :ロシュ製 #10 127 876 001グルタミン酸Na:富士フイルム和光純薬製 特級 #198–02035
酵素試料液
- 検品約10mg を精密に量り、酵素溶解希釈用液に溶解して全容10ml とする。
その液を酵素溶解希釈用液で適宜希釈する。
測定操作法
- 小試験管に、反応試薬混合液 3.0ml を正確に分注し、37℃で予備加温する。
- 5 分後、酵素試料液0.06ml を正確に加えて混和し、37℃で反応を開始する。
- 反応開始後、340nm における吸光度を測定して直線的に反応している1分間当たりの吸光度変化を求める。 (直線範囲例:3 分から6 分) 求められた吸光度変化を試料液についてはAs/min、盲検液についてはAb/min とする。
△ A/min = (As/min - Ab/min) =≦ 0.15Abs/min
-
計算
以下の計算式に従い、活性 (U/mg) を計算する。
活性 (U/mg) = {(△A/min)/6.3} × 3.06/0.06 × 1/x6.3 : NADH の340nm におけるミリモル分子吸光係数 (cm2/ μmol)3.06 : 総反応液量 (ml) 0.06 : 反応に供した酵素試料液量 (ml) X : 試料液中の酵素検品濃度 (mg/ml)
Copyright © Asahi Kasei Pharma Corporation. All rights reserved.